森西赛智科技有限公司
15 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
推荐产品
技术资料/正文
Nature Neuroscience:MERFISH空转分析 揭示衰老大脑中神经胶质细胞和免疫细胞的相互作用(上)
20 人阅读发布时间:2026-01-14 15:46
Nature Neuroscience:MERFISH空转分析
揭示衰老大脑中神经胶质细胞和免疫细胞的相互作用
森西赛智科技有限公司
(一)《Nature Neuroscience》新作
2025年5月22日Nature子刊《Nature Neuroscience》发布了德国慕尼黑工业大学神经细胞生物学研究所的Dr. Janos Groh团队的最新研究成果:Microglia activation orchestrates CXCL10-mediated CD8+ T cell recruitment to promote aging-related white matter degeneration(小胶质细胞的激活能够调控由CXCL10介导的CD8+T细胞的募集,从而促进与衰老相关的白质退化)(图1)。本研究利用MERFISH单细胞空间转录组学技术,揭示了神经胶质细胞和免疫细胞之间复杂的细胞和分子相互作用,即功能失调且失调性激活的小胶质细胞通过趋化因子信号传导促进有害的CD8+ T细胞在衰老的白质中的募集和留存,为针对年龄相关神经退行性疾病的新治疗干预提供了新的途径。

图1. 论文标题。【1】
(二)论文摘要
衰老是神经退行性疾病的主要风险因素,并与白质的结构和功能变化有关。髓鞘尤其容易受到衰老的影响,从而导致与白质相关的小胶质细胞激活。在此,我们采用药理学和基因方法来研究与小鼠髓鞘化轴突的衰老相关变化有关的小胶质细胞功能。我们的研究结果表明:适应不良的小胶质细胞激活会促进有害的CD8+ T细胞的积累,导致髓鞘化轴突的退化以及随后的脑功能和行为的损害。我们通过单细胞和空间转录组学方法表征了白质中的神经胶质异质性和其与衰老相关的变化,并揭示了复杂的神经胶质-免疫相互作用。从机制上讲,我们表明CXCL10-CXCR3轴对于在衰老的白质中招募和保留CD8+ T细胞至关重要,在那里它们发挥致病作用。我们的研究结果表明:与髓鞘相关的小胶质细胞功能障碍会促进衰老过程中的适应性免疫反应,并确定了可能的靶点以减轻其不利影响。
(三)主要研究内容
3.1 研究背景
大脑中的白质结构,主要由髓鞘化的轴突组成,容易受到与衰老相关的变化的影响。随着年龄的增长,大脑中的白质体积会减少,其微观结构也会发生变化,并会出现局部病变,主要表现为小血管病变、髓鞘改变和轴突损失。例如白质束的完整性受损,有髓鞘的神经纤维的局部区域变松散、冗余和髓鞘退化,以及轴突损伤。衰老过程中,白质中会出现一种独特的小胶质细胞状态,即与白质相关的小胶质细胞(white matter-associated microglia,WAM),积极参与清除异常的髓鞘。在衰老的大脑中,小胶质细胞会出现脂滴积累、吞噬作用受损、活性氧水平高以及分泌促炎细胞因子等特征;或显示出小胶质功能障碍,例如类似于脂褐素的不溶性溶酶体包涵体的积累,以及像细胞质球体、卷曲和碎片化这样的营养不良变化。
本文研究中,研究者利用药理学和遗传学工具来研究小鼠大脑白质中髓鞘轴突发生衰老相关变化时小胶质细胞的功能。实验目标如下:
l 研究衰老导致的小胶质细胞功能障碍如何通过免疫细胞相互作用导致白质退化;
l 探究CXCL10-CXCR3趋化因子轴在将CD8+ T细胞招募至衰老大脑白质中的作用;
l 利用单细胞和空间转录组学技术来表征神经退行性疾病背后的细胞参与者及其相互作用。
3.2 实验结果
1、适应不良的小胶质细胞激活会加剧白质的衰老
为了研究与衰老相关的髓鞘完整性变化,研究者以小鼠视神经作为研究对象,因为其是中枢神经系统(CNS)中一种特征明确、易于获取且具有分隔结构的白质束。发现老年小鼠的视神经中的髓鞘出现了紊乱和脱失,证实并扩展了之前关于大脑白质老化的认知,并表明其特征在视神经中也明显可见。对人类冷冻大脑样本的分析也表明其与在小鼠中的观察结果相一致:在所有神经胶质细胞中检测到了与衰老相关的促炎反应,并且发现主要现象是CD8+ T细胞的积累,这些人类脑样本具有组织驻留记忆(TRM)特征。
为了探究小胶质细胞在白质老化过程中的作用,研究者使用小分子抑制剂PLX5622靶向慢性清除CNS中CSF-1R依赖的髓系细胞,并应用于衰老的CX3CR1缺陷型(Cx3cr1gfp/gfp)小鼠。两种干预( “清除稳态小胶质细胞”(PLX5622)和 “阻断其关键功能信号”(CX3CR1 缺陷))虽对小胶质细胞的 “数量影响” 不相同,但均会导致小胶质细胞活化、功能异常(如吞噬能力下降、稳态丢失),无法正常清除异常髓鞘,且最终都引发白质(髓鞘)的结构损伤,为后续探究小胶质细胞与CD8+ T细胞的相互作用奠定了基础。
然后通过单细胞RNA测序(scRNA-seq)技术,聚焦PLX5622处理后衰老小鼠脑内非神经元细胞(尤其是小胶质细胞)的转录组变化,针对性地对小胶质细胞亚群进行了细分,通过纳入PLX5622介导的小胶质细胞耗竭组,发现了第三种白质相关小胶质细胞(WAM)亚群,其差异表达基因同时包含前两种已知WAM亚群的特征性基因(图2a-c),并显著积累,显示出与炎症反应、抗原加工与呈递、T 细胞介导的免疫以及氧化磷酸化相关的基因表达显著增强。同时还研究了PLX5622处理对衰老小鼠脑内的少突胶质细胞和星形胶质细胞的转录组的影响。scRNA-seq结果从转录组层面揭示了PLX5622处理的核心作用机制:它并非简单耗竭小胶质细胞,而是通过“选择性清除稳态小胶质细胞、诱导新型促免疫WAM亚群积累”,重塑小胶质细胞的功能格局;一方面导致促炎小胶质细胞比例升高,直接释放炎症因子加剧神经炎症;另一方面间接诱导少突胶质细胞应激、星形胶质细胞毒性活化,形成 “胶质细胞异常活化网络”。因此,对老年小鼠进行PLX5622处理或消除CX3CR1,会损害其体内正常的小胶质细胞功能,从而导致促炎性小胶质细胞数量增加、髓鞘完整性改变、轴突退化以及视觉功能下降。
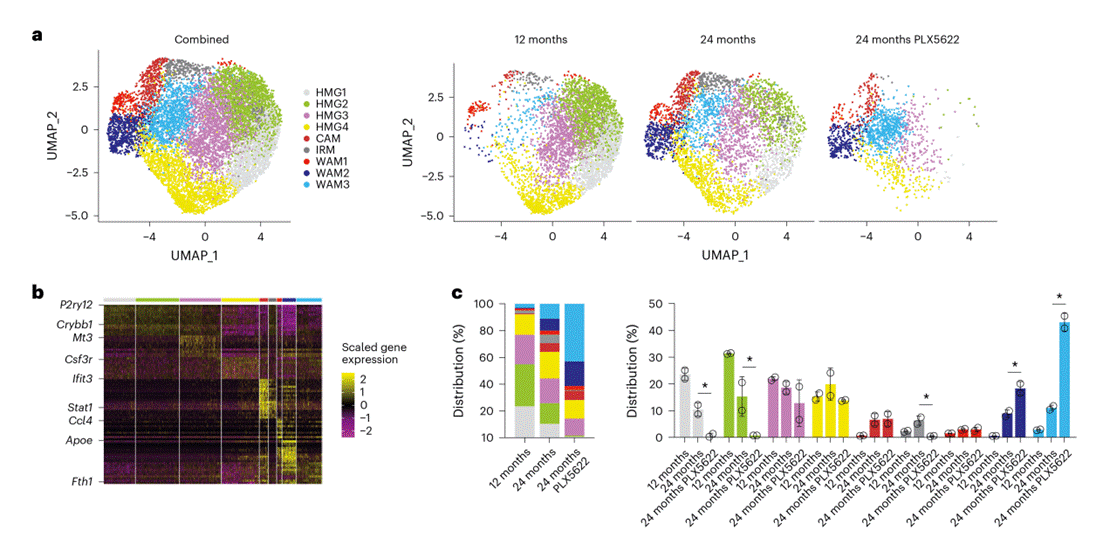
图2. scRNA-seq 技术揭示了在使用 PLX5622 处理后,与衰老相关的小胶质细胞特征。(图3a-c)
2、PLX5622处理后,CD8+ T细胞会加剧老年小鼠的轴突丢失
为了探究促炎症反应增强及功能障碍如何导致髓鞘纤维损失加剧,研究者对适应性免疫反应进行了研究,这类反应已被证实与与衰老相关的白质损伤有关。老年小鼠用PLX5622处理,或敲除CX3CR1后,视神经实质中的CD8+ T细胞数量显著增加,但CD4+ T细胞数量无变化(图3a-b);这些增多的CD8+ T细胞还更频繁地出现在CD11c+小胶质细胞附近。按照不同的处理方案加入PLX5622,随着处理时间的增加,发现CD8+ T细胞数量有所增加,同时轴突受损情况也有所加重。scRNA-seq分析显示,PLX5622处理的老年小鼠中,T 细胞集群从CD4⁺Th1细胞标志物向CD8⁺ T细胞标志物偏移(图3c-e),这些CD8⁺ T细胞具有组织留驻记忆T细胞(TRM)的核心特征,通过释放GZMB(细胞毒性效应蛋白酶颗粒酶B)等毒性分子(图3f-g )靶向损伤轴突,最终加剧轴突损失。
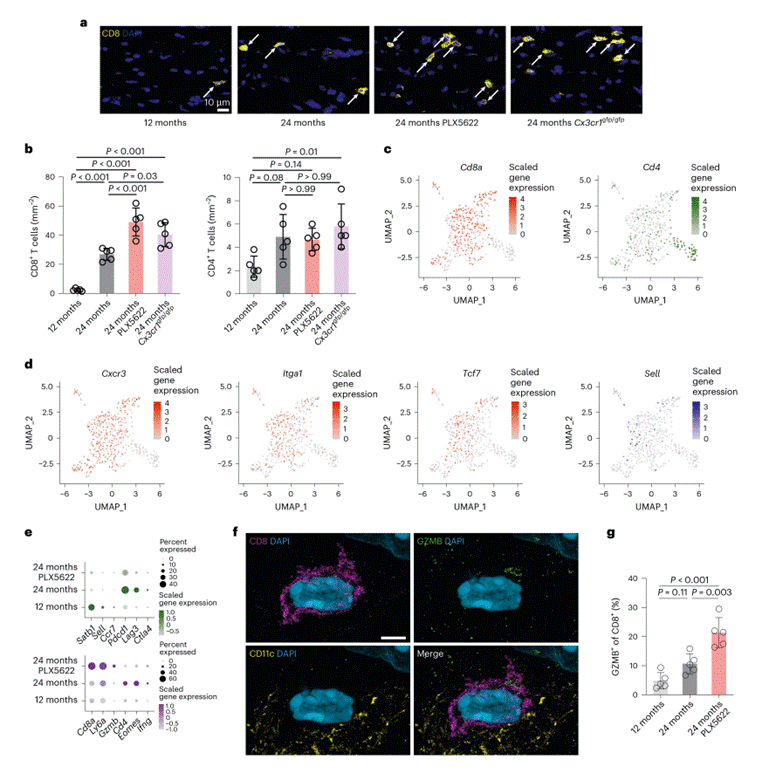
图3. 适应不良的小胶质细胞激活会促使CD8+ T细胞在老年脑白质区域的聚集。(图4)
为明确CD8⁺ T细胞与轴突损失的因果关系,研究对Cd8⁻/⁻小鼠进行PLX5622处理。发现PLX5622处理的成年小鼠体内CD8+ T细胞的缺失会造成轴突球体形成减少、轴突退化程度减轻、视网膜神经节细胞(RGC)损失减少、视网膜内层变薄缓解、视觉功能维持更佳(图4c-j);Cd8⁻/⁻小鼠的实验直接证实了CD8⁺ T细胞是这一病理过程的核心介导者。
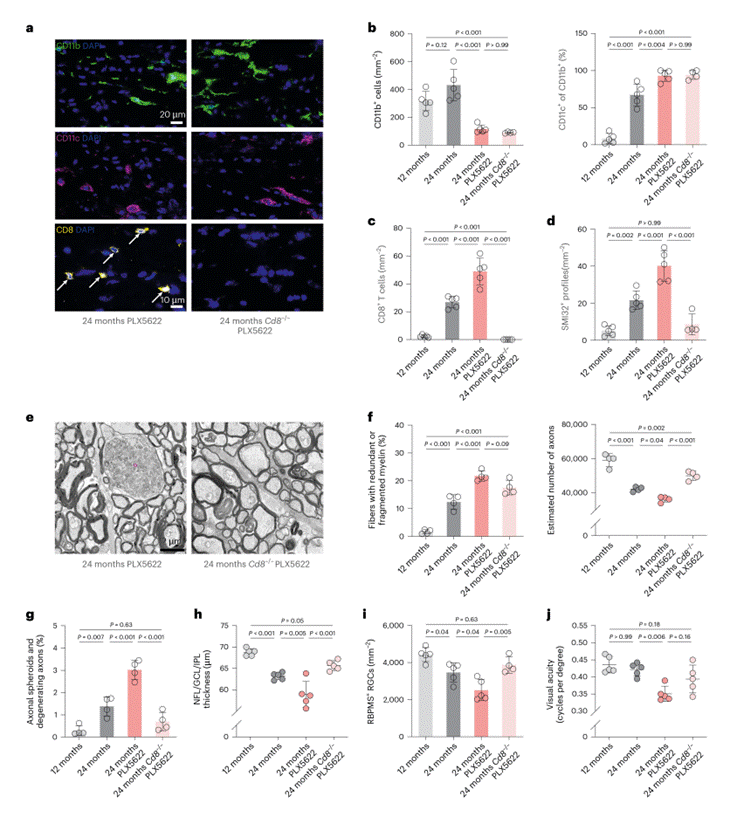
图4. CD8+ T 细胞促使接受PLX5622处理的老年小鼠出现更严重的轴突退化现象。(图5)
3、MERFISH技术在老年视神经中检测到了与T细胞相邻的Cxcl10表达
为解析“激活的小胶质细胞如何调控老年白质中CD8+ T 细胞募集” 这一核心问题,研究团队采用空间分辨单细胞转录组技术 MERFISH(多重抗错荧光原位杂交),通过定制的500 gene panel对成年、老年及PLX5622处理老年小鼠的视神经横/纵切片进行分析,最终明确了T细胞与Cxcl10(关键趋化因子)的空间关联。
MERFISH的核心价值在于亚细胞转录本分辨率,既能识别视神经实质及脑膜结构中的所有主要细胞类型(如小胶质细胞、星形胶质细胞、少突胶质细胞、T细胞等),又能精准定位目标基因(如Cxcl10)的表达位置(图5a-c)。实验针对三类小鼠视神经样本:成年(12月龄)、老年(24月龄)、PLX5622处理老年(18-24月龄持续给药)小鼠,覆盖 “衰老+小胶质细胞耗竭” 的关键干预场景。对“单个实质T细胞数量”的计数显示:PLX5622处理的老年小鼠中T细胞数最多。
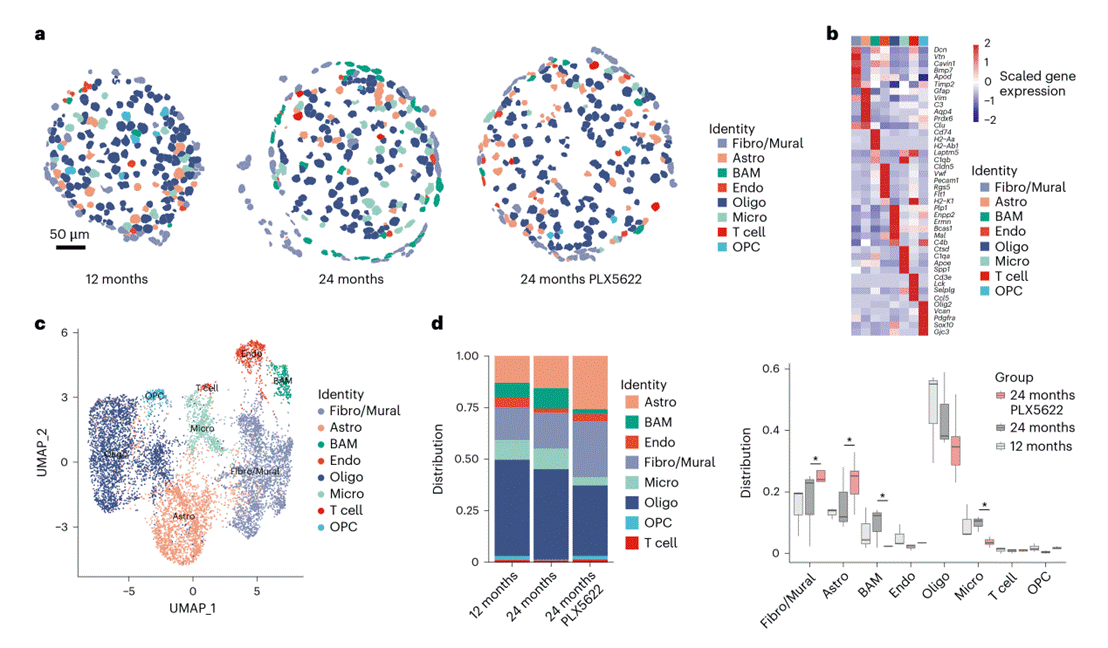
图5. PLX5622处理后老年视神经的时空分辨率单细胞转录组学研究。(图6)
基于既往文献及自身单细胞转录组数据,筛选出“胶质细胞激活相关转录本列表”,通过MERFISH数据,计算基因模块激活评分,量化胶质细胞状态。衰老本身会导致视神经中少突胶质细胞、星形胶质细胞、小胶质细胞的激活评分均显著升高,表明三类胶质细胞均参与衰老相关的白质炎症反应(图6e 及图7a)。PLX5622处理进一步强化这一趋势:在老年小鼠中,该处理显著提升小胶质细胞激活标志物(如CD11c、促炎基因)的表达,对少突胶质细胞的稳态及反应性标志物影响较弱;同时,星形胶质细胞不仅数量增加,其激活标志物(如GFAP、促炎相关基因)的表达也显著上调。
MERFISH的核心突破在于解析“细胞邻域”与“基因表达”的空间关联,直接证实 “Cxcl10 在T细胞附近表达”。老年视神经中的T细胞以CD8+组织驻留记忆T细胞(TRM)为主,且常表达细胞毒性效应分子(如GZMB,图7b)。研究发现:T细胞及小胶质细胞与“激活大胶质细胞(星形胶质细胞、少突胶质细胞)表达的转录本”存在显著的邻域关联评分,其中关键趋化因子Cxcl10主要在反应性星形胶质细胞中检测到,而另一标志物Serpina3n则主要来自反应性少突胶质细胞(图6f 及图7c)。进一步空间定位显示:CD8+ T细胞优先分布在反应性少突胶质细胞、激活小胶质细胞及反应性星形胶质细胞的附近(图6g),直接证明“分泌Cxcl10的反应性星形胶质细胞”与“CD8+ T细胞”存在物理邻近关系,为“Cxcl10招募CD8+ T细胞至老年白质”提供了空间层面的直接证据。
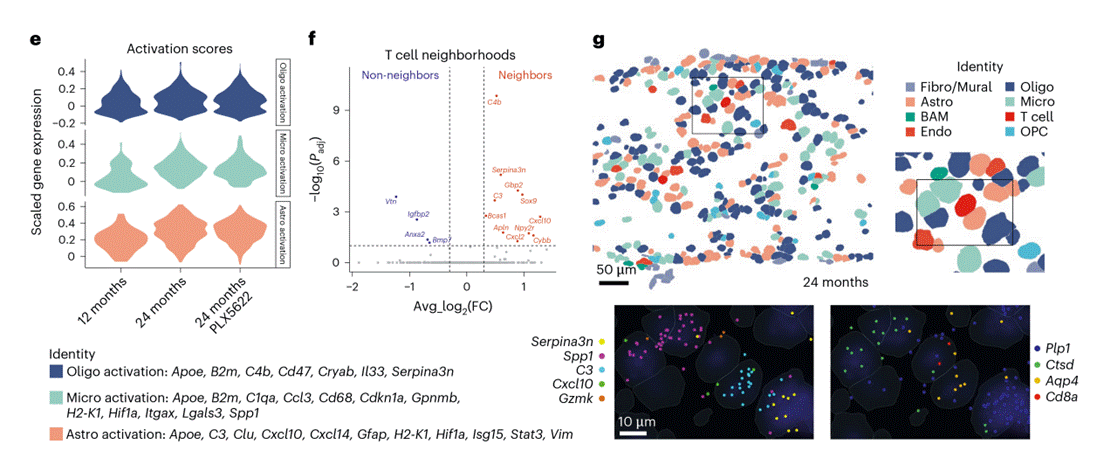
图6. PLX5622处理后老年视神经的时空分辨率单细胞转录组学研究。(图6)
MERFISH还进一步佐证了PLX5622的效应:该处理会导致老年视神经中“促炎激活标志物”(如之前发现的CD11c、促炎细胞因子基因)表达升高,并能区分出不同的白质相关小胶质细胞(WAM)状态(图7d-e)。MERFISH与scRNA-seq及免疫荧光结果相互印证,确保了“Cxcl10在T细胞附近表达”这一发现的可靠性。
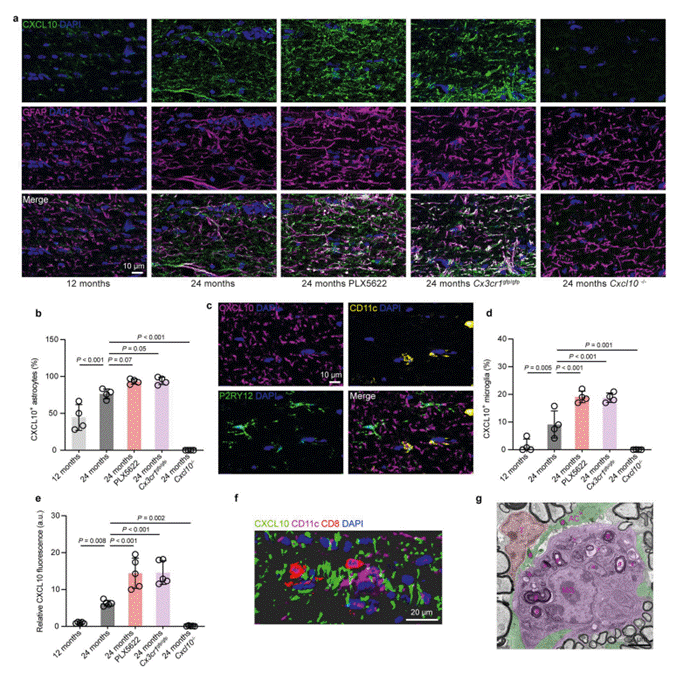
图7. PLX5622处理或CX3CR1缺陷会增强与衰老相关的CXCL10的表达。(补充图9)
综上,MERFISH通过“空间分辨转录组”技术,不仅确认了老年视神经中CD8+ T细胞的TRM表型,更关键的是直接定位了“Cxcl10主要来自反应性星形胶质细胞”且“Cxcl10表达区域与CD8+ T细胞高度邻近”,为后续“CXCL10-CXCR3轴调控CD8+ T细胞募集”的机制验证奠定了空间分布基础。
4、CXCL10 - CXCR3信号通路将CD8+ T细胞招募至衰老的神经组织中
该部分围绕“CXCL10-CXCR3轴调控老年白质中CD8+ T细胞募集”的核心机制,通过多模型验证(基因敲除、骨髓移植)与多技术交叉佐证(细胞通讯分析、qRT-PCR、免疫荧光),层层递进证实“小胶质细胞激活→星形胶质细胞 / CXCL10上调→CD8+ T细胞(表达CXCR3)被吸引至CXCL10区域”的机制闭环,直接支持 “CXCL10-CXCR3轴调控CD8+ T细胞募集到老年白质”的核心结论,同时明确CXCR3对CD8+ T细胞长期驻留的关键作用。
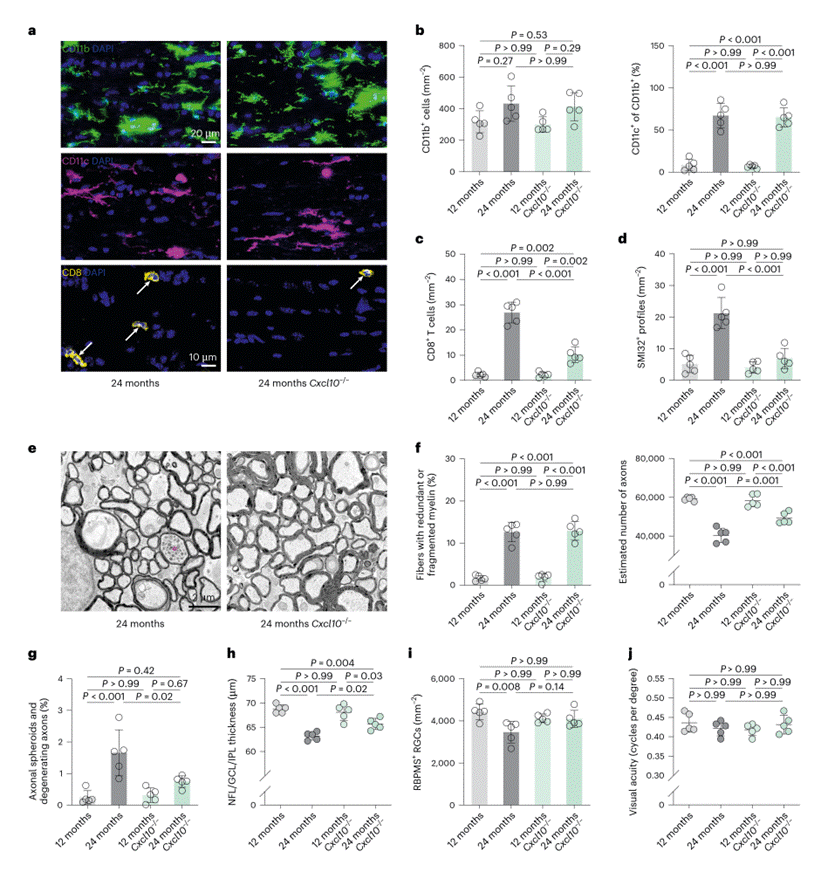
图8. CXCL10能促进老年视神经中CD8+ T细胞的募集以及轴突的退化。(图7)






